암이 발생, 진행되고 약물에 대해 내성을 갖게 되는 데에는 종양유전자의 활성화와 종양억제 유전자의 불활성화로 요약할 수 있는 유전자 발현의 후생적 조절(epigenetic control)이 매우 중요한 역할을 합니다. 후생적 조절(epigenetic control)이란 DNA 염기서열이 변하지 않는 상태에서 이루어지는 유전자 발현의 조절을 일컬으며, 몇 가지 화학적변형을 통해 DNA가 팩킹(packing: DNA는 당과 단백질이 단추역할처럼 후크를 만들어 팩킹되어 안전하게 보존되어 있다가 필요시 떼어내 사용) 되는 것을 바꾸는 스위치가 꺼지거나 켜지기 용이하도록 만드는 것입니다. 이러한 패턴의 변화가 자연적으로 활성화되는 것은 무엇보다도 개개인마다 처한 독특한 환경적 요인이나 스트레스, 식습관, 운동, 독성물질에 노출 등에 의해 영향을 받습니다. 유전자발현의 후생적 리모델링(epigenetic remodeling) 동안 나타나는 후생적 변화는 크게 3가지 형태로 구분됩니다.
유전자 발현의 후생적 리모델딩(epigenetic remodeling)에는 여러 효소들이 관련되어 있습니다. DNA가 히스톤(histone)이라는 단백질 주위에 단단히 묶여 있는 구조가 모여서 염색질(chromatin)이란 구조를 만드는데, 바로 이러한 구조가 유전자를 효과적으로 제어합니다. 히스톤(histon)에서 아세틸기(acetyl groups) 단백질을 제거하는 히스톤 탈아세틸화 (histone deacetylation)는 히스톤 탈아세틸화 효소(histone deacetylases: HDAC)에 의해 일어납니다. 이것은 히스톤 아세틸화효소(histone acetyltransferase)의 작용과는 정 반대의 작용입니다. 히스톤 탈아세틸화 효소 (HDAC)는 종양억제유전자의 발현을 조절할 수 있고, DNA나 DNA를 싸고 있는 염색질(chromatin)의 구성성분의 변형을 통해 암의 발생과 진행에 관련된 전사인자의 활성을 조절할 수 있습니다. 단백질의 아세틸화(acetylation)는 암세포에서 흔히 변형이 나타나는 히스톤 탈아세틸화 효소(HDAC)에 의해 되돌려질 수 있는 과정입니다. 만일 우리가 이러한 히스톤 탈아세틸화 효소(HDAC)의 작용에 의해 나타나는 암세포의 성장유전자의 발현을 조절한다면 암세포는 죽을 것입니다.
HDAC family: What are the cancer relevant targets?
Role for histone deacetylase 1 in human tumor cell proliferation.
Histone acetylation and the cell-cycle in cancer.
The role of histone deacetylases in prostate cancer.
Class I histone deacetylases 1, 2 and 3 are highly expressed in renal cell cancer.
그러므로, 종양에서 유전자 발현의 후생적환경(epigenetic environment)을 변형시키는 성분은 효과적인 항암 무기로 추가 사용될 수 있을 것입니다. 최근에는 암환자의 임상치료에서 히스톤 탈아세틸화 효소(HDAC) 억제제를 사용한 아세틸화(acetylation)의 조절을 통해 암의 성장에 관여하는 단백질들을 차단하는 치료법들이 평가되고 있습니다.
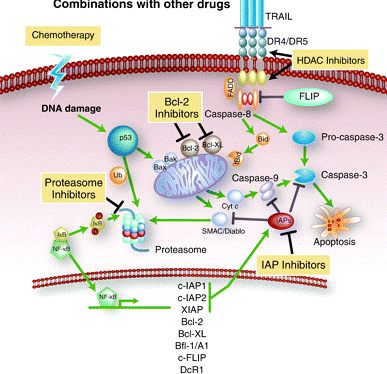 히스톤 탈아세틸화 효소억제제(HDACi)는 내재적사멸경로(intrinsic apoptosis pathway)와 사멸수용체(death-receptor: DR4, DR5) 양쪽을 모두 활성화시킵니다. 사멸수용체(death-receptor) 경로는 사멸신호가 수용체에 결합하고, 그 결과 수용체 내부도메인인 세포사멸 도메인(death domain: FADD)을 활성화시켜 카스파제(caspase)-8을 활성화시키고, 활성화된 카스파제(caspase)-8이 직접적으로 이펙터 카스파제(effector caspases)인 카스파제(caspase)-3을 바로 활성화 시켜 세포사멸을 유도합니다.
히스톤 탈아세틸화 효소억제제(HDACi)는 내재적사멸경로(intrinsic apoptosis pathway)와 사멸수용체(death-receptor: DR4, DR5) 양쪽을 모두 활성화시킵니다. 사멸수용체(death-receptor) 경로는 사멸신호가 수용체에 결합하고, 그 결과 수용체 내부도메인인 세포사멸 도메인(death domain: FADD)을 활성화시켜 카스파제(caspase)-8을 활성화시키고, 활성화된 카스파제(caspase)-8이 직접적으로 이펙터 카스파제(effector caspases)인 카스파제(caspase)-3을 바로 활성화 시켜 세포사멸을 유도합니다.
미토콘드리아 막(mitochondrial membrane)으로부터 사이토크롬(cytochrome) c의 유리가 일어나는 내재적사멸경로는 전구 사멸 단백질인 BAX와 BAK에 의해 매개되는 내부 스트레스(internal stresses)에 의해 유도됩니다. 히스톤 탈아세틸화 효소억제제(HDACi)는 내재적사멸경로를 활성화시킬 수 있으며, 또한 HDACi는 ROS(활성기 산소)가 생성된 후에는 세포자살을 실행(execution)하는 효소인 카스파제(caspase)의 활성이 나타나지 않아도 계속 세포사멸을 유도합니다.
HDAC inhibitors in cancer care.
Novel histone deacetylase inhibitors in clinical trials as anti-cancer agents.
Histone deacetylase inhibitors in cancer therapy.
Histone deacetylase inhibitors as anti-neoplastic agents.
백혈병(leukemia)은 크게 4가지 종류로 구분되며, 만성골수성백혈병(CLL)은 그 중 하나입니다. 만성골수성백혈병(CLL)은 제대로 기능을 발휘하는 성숙한 림프구가 현저하게 증가하는 것이 특징입니다. 다시 말하면 죽어야 할 세포들이 죽지 않는 것입니다. 만성골수성백혈병(CLL) 세포들은 세포사멸을 유도하는 리간드인TRAIL(tumor necrosis factor-related apoptosis-inducing ligand)에 저항하는 능력을 지닙니다. 연구보고는 히스톤 탈아세틸화 효소억제제(HDACi)가 세포사멸촉진 단백질(Fas-associated death domain : FADD)을 세포 표면의 사멸수용체(TRAIL receptor; DR4)에 불러모아 결합한 후 복합적인 경로들을 활성화시켜 세포자멸사(apoptosis)를 유발한다는 것을 보여줍니다. 그러므로 만성골수성백혈병(CLL)세포가 TRAIL의 사멸유도에 민감하게 되도록 매개하는 HDACi의 작용에서 FADD를 불러모으는 단계를 거치는 것은 대단히 중요합니다. FADD를 불러모으는 단계는 히스톤 탈아세틸화 효소억제제(HDACi)가 특이하게 미치는 영향입니다.
암 종양세포는 에너지를 얻기 위해 당분해(glycolysis) 과정을 제어하지만 정상세포와 달리 피루베이트(pyruvate)를 산소를 이용해 산화시키지 않고 유산(lactate)으로 변환시킵니다. LDH (lactate dehydrogenase)는 당이 분해되어 에너지로 변할때 작용하는 효소의 하나입니다. 대장암(colon cancer) 세포는 LDH (lactate dehydrogenase)-B 유전자를 불활성화 시키고, LDH (lactate dehydrogenase)-A 유전자를 제어하며, 그 결과 피루베이트(pyruvate)를 산화시키지 않고 유산(lactate)으로 효과적으로 변환시키는 것으로 밝혀졌습니다. 이것은 정상세포에 비해 암세포에서 피루베이트(pyruvate) 수준이 현격히 줄어드는 것과 관련이 있습니다. 암세포에서 LDH-B의 불활성화는 DNA 메틸전환효소(methyltransferases)의 작용을 통한 DNA 메틸화(methylation)에 의해 나타납니다. 또한 대장암은 빠른 속도로 성장하는세포에 특징적인 효소로서 종양대사 시 당분해에 중요한 역할을 하는 M2-PK (pyruvate kinase M2) 효소의 발현과 관련이 있습니다. PK(pyruvate kinase )효소들은 활성 상태에서 동형 사중체(homotetramer)로 존재하나 종양세포에서는 대부분 이중체(dimeric) M2-PK로 존재하여 Tumor M2-PK로 불립니다. 피루베이트(pyruvate)는 히스톤 탈아세틸화 효소(HDAC1 과 HDAC3)를 억제합니다. 유산(lactate)은 어느 히스톤 탈아세틸화 효소(HDAC)에도 영향을 미치지 못합니다.
히스톤 탈아세틸화 효소(HDAC)는 대장세포의 성숙과 변형을 조절하고, 대장암세포는 정상세포에 비해 HDAC의 활성이 증가하는 것으로 나타납니다. 유산(lactate)은 아니지만, 피루베이트(pyruvate)는 히스톤 탈아세틸화 효소(HDAC) 억제제며, 종양세포에서 세포사멸 유도물질입니다. 이 과정에 관련된 것이 SLC5A8이란 나트륨이온(NA+) 연계 피루베이트(pyruvate)운반체 조절 유전자로 대장암세포에서는 활성화 되지 못합니다. 이피루베이트(pyruvate)운반 과정은 세포간 피루베이트(pyruvate)의 수준을 높이고, 히스톤 H4의 아세틸화(acetylation)를 증가시키며, 세포 사멸(cell death)을 촉진합니다. 다음 연구보고는 피루베이트(pyruvate)가 히스톤 탈아세틸화 효소(HDAC1 과 HDAC3)를 억제하는 것을 막기 위해 암세포는 낮은 수준의 피루베이트(pyruvate)를 효과적으로 유지하고, 그리하여 피루베이트(pyruvate)가 유도하는 세포사멸(cell death)을 회피한다는 것을 보여줍니다. 암 종양이 피루베이트(pyruvate)를 유산(lactate)으로 변환시키는 특유의 대사과정은 피루베이트(pyruvate)가 유도하는 세포사멸(cell death)을 회피하기 위한 보완기전(complementary mechanisms)인 것입니다.
SLC5A8 triggers tumor cell apoptosis through pyruvate-dependent inhibition of histone deacetylases.
Structural basis for tumor pyruvate kinase M2 allosteric regulation and catalysis.
HDACs and HDAC inhibitors in colon cancer.
계속합니다.
ⓒ 저작권(copyright) 법에 의해 본 사이트(http://www.herbalzym.com)에 게시된 글은 보호받으므로 무단전재 및 재배포를 금지합니다. 저작권문의는 herbalzym@hotmail.com 으로 하시기 바랍니다.