결핵은 가장 치명적인 감염질환의 하나입니다. 지난해의 경우 전세계적으로 약 천만명이 새로 결핵에 감염되었고 160만명이 사망했습니다.
일반 결핵은 매일 4종의 항결핵제를 6~9개월간 투여해야 치유됩니다. 결핵환자의 약 절반은 증세가 호전되면 약 복용을 조기 중단해 감염 장기화, 약제내성 발생, 재발, 사망에 이르기도 합니다.
약제내성 결핵은 내성균발생 (결핵균의 변화) 또는 환자와 직접 접촉으로 생깁니다. 약제내성 결핵의 치료기간은 약 2년이며 치료가 훨씬 더 어렵습니다. 약제들도 더 독하며, 치료율도 약 50% 정도입니다. 약제내성 결핵은 결핵환자의 약 30%로 증가추세입니다.
약제내성 결핵의 표준요법은 매일 고통스런 주사제와 함께 오심, 구토, 영구청력손상, 정신착란, 신장기능저하 같은 여러 끔찍한 부작용이 따르는 독한 2차 항결핵제를 조합해 약 2년간 투여하므로 치료가 매우 힘듭니다.
.
약제내성 결핵의 분류
• MDR (다제내성 결핵); 리팜피신, 아이나 (Isoniazid)에 동시내성 보유. 사망율 30%.
• XDR (광범위내성 결핵, 슈퍼결핵); 리팜피신, 아이나 (Isoniazid) 및 퀴놀론계 1종을 비롯해 3종 항생제 (카나마이신, 아미카신, 카프레오마이신) 중 1가지 이상 내성을 동시 보유. 사망율 80%
• TDR (전약제내성 결핵); 모든 항결핵제에 내성 신종균. 사망율 100%
약제내성 결핵은 사망원인 최고의 감염질환입니다. 반가운 소식은 약제내성 결핵균의 퇴치가 가능한 세계 최초의 강력한 자연 면역요법이 개발되었다는 것입니다. 인체 면역계는 병원균을 감지하고 면역세포와 면역물질을 생성하여 이들을 파괴하는 시스템입니다.
그러나 결핵균은 선천면역계와 적응면역계에 의한 퇴치를 회피하기 위한 여러 속임수를 발전시켜 왔습니다. 대식세포는 결핵균의 감지에 결정적인 역할을 합니다. 그러나 결핵균은 대식세포의 방어를 무력화시킬 수 있습니다. 더욱이 결핵균은 면역계가 결핵균의 확산을 허용하도록 트릭을 사용합니다.
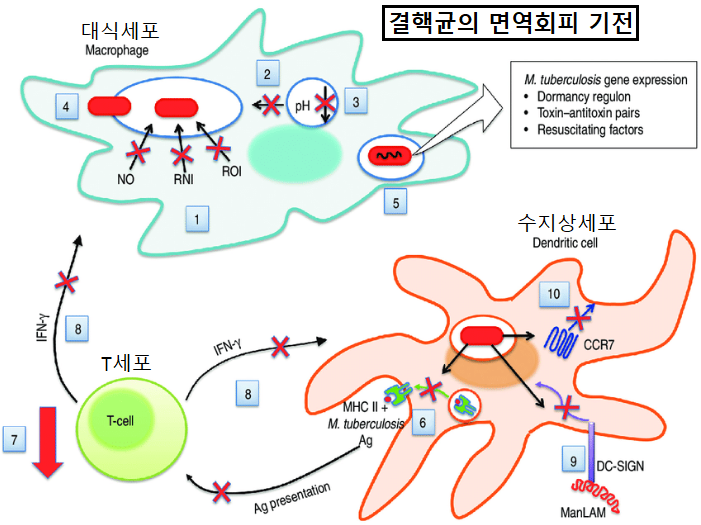
항결핵제의 사용 대신 인체의 면역반응을 조절하여 약제내성 결핵균을 죽이는 치료가 이론상 가능합니다. 면역조절은 단순한 면역력의 증진과는 차원이 다릅니다. 여기에는 균형잡힌 지속상태로 면역기능을 되돌리는 것이 포함됩니다. 면역계는 인위적으로 조절할 수 없다는 것이 지금까지의 통념입니다.
그러나, 우리는 천연, 유기농 성분이 함유된 특정 자연 면역보충제를 사용해 면역반응을 다차원적으로 조절 및 강화시킬 수 있습니다. TB-허발짐™은 강화제 형태의 자연 면역조절제로 약제내성 결핵환자들의 임상시험치료에서 경이로운 치료효과를 보였습니다.
거의 100%의 환자들 (다수의 한국 남성 및 여성 약제내성 결핵환자들)이 지속된 임상치료에서 30일 내에 성공적으로 치유되었습니다. 이 임상치료 결과는 약제내성 결핵환자들에게 독한 항결핵제 없이도 치유될 수 있다는 희망을 줍니다. 기적같이 믿기 힘든 뉴스지만 사실입니다.
TB-허발짐™은 결핵병리학과 결핵균 면역회피의 기전적 고찰을 통해 개발되었습니다. TB-허발짐™은 면역계의 복합 요소들이 적정하게 작용하도록 세포간 신호경로를 활용합니다. TB-허발짐™에는 최신 연구를 근거로 조성된 35종의 효소적 발효처리된 생리활성 천연성분들이 들어있어, 적정 면역반응을 유도하는 잠재적 치료효능을 지니고 있습니다.
약제내성 (MDR, XDR, TDR) 결핵으로 고통받는 환자라면 TB 허발짐™에 추가하여 TB 박테짐™과 TB 테안짐™을 함께 사용할 수 있습니다. 이들 3종 자연보충제의 조합은 임상치료에서 강력한 시너지효과를 만들었습니다. 이제 약제내성 결핵은 매우 짧은 기간에 전혀 부작용 없이 완치가 가능해졌습니다.
Innate Immune Responses to Tuberculosis.
Tuberculosis and the art of macrophage manipulation.
Molecular basis of mycobacterial survival in macrophages.
IFN-β: A Contentious Player in Host-Pathogen Interaction in Tuberculosis.
Exosomal RNA from Mycobacterium tuberculosis-Infected Cells Is Functional in Recipient Macrophages.
Mycobacterium tuberculosis: Manipulator of Protective Immunity.
Host sirtuin 1 regulates mycobacterial immunopathogenesis and represents a therapeutic target against tuberculosis.
Microbial co-infection alters macrophage polarization, phagosomal escape, and microbial killing.
Innate immunity in tuberculosis: host defense vs pathogen evasion.
Expression of inhibitory regulators of innate immunity in patients with active tuberculosis.
Mathematical model of mycobacterium-host interaction describes physiology of persistence.
Immunoevasion and immunosuppression of the macrophage by Mycobacterium tuberculosis.
Understanding and overcoming the barriers to T cell-mediated immunity against tuberculosis.
Cell death and autophagy in tuberculosis.
Cellular and humoral mechanisms involved in the control of tuberculosis.
The innate immune response in human tuberculosis.
Modulation of cell death by M. tuberculosis as a strategy for pathogen survival.
TB: screening for responses to a vile visitor.
DC-SIGN and mannosylated surface structures of Mycobacterium tuberculosis: a deceptive liaison.