인체에 들어있는 가장 많은 미량원소는 뼈를 구성하는 칼슘과 인(phosphorus)이며, 그 다음이 유황(sulfur)입니다. 유황은 거의 대부분 필요량을 우리의 식이를 통해 섭취할 수 있으며, 유황함유 단백질에 정상적으로 들어있는 20종류의 아미노산 중 현재까지 확인된 단 두 종류의 유황 아미노산만이 유황의 주 공급원입니다. 유황함유 아미노산은 메티오닌(methionine)과 시스테인(cysteine)이며, 주로 붉은색 육류와 유제품(dairy products)에 많이 들어있습니다.
단백질에는3%-6%의 유황아미노산(sulfur amino acids)이 함유되어 있습니다. 우리는 아주 적은양의 유황을 무기유황(inorganic sulfates) 형태로, 그리고 마늘과 양파, 브로콜리 같은 식품에 함유된 다른 형태의 유기유황(organic sulfur)으로부터 얻게됩니다. 유황아미노산 두 가지의 대사작용은 밀접하게 연관되어 있습니다. 메티오닌(methionine)은 포유류의 대사작용에서 많은 핵심역할을 하는 필수아미노산(반드시 식이를 통해 섭취)입니다. 메티오닌(methionine)은 사람의 간에서 시스테인(cysteine)으로 전환되는 전구체(precursor)입니다.
시스테인(cysteine)은 상당한 필요량이 체내에서 메티오닌(methionine)으로 부터 합성되므로 준필수아미노산(semiessential amino acids)으로 분류됩니다. 또한 메티오닌(methionine)은 시스테인(cysteine)으로 부터 재생될 수는 없으므로, 베타인(콜린이 산화되어 베타인으로 전환됨), 엽산(folate), 또는 비타민B12 (Cobalamin) 같은 메틸기(단일 탄소) 공여체를 이용하는 호모시스테인(homocysteine)의 메틸화를 통해 메티오닌으로 재생됩니다 (메틸화는 다양한 화학반응, 대사반응에 필요).
유황은 생명유지에 중요한 핵심원소이면서도 건강을 해칠 수도 있는 양면성이 있습니다. 염증성장질환(IBD)이 많이 발생하는 지역의 현대적 식단에서 중요한 변화의 하나는 유황함유식품의 섭취율이 높아진 것입니다. 장내 유황재이용 펌프(sulfur salvage pump)에 의해 재처리되지 못한 유황은 대장으로 유입되어 궤양성대장염 환자에서 훨씬 더 많이 존재하는 것이 확인되고, 특히 궤양성대장염의 발적확장(flare)과 관련된 황산염환원균(sulfate reducing bacteria: SRB)에 의해 일부 대사됩니다.
많은 장내균들이 유황함유 세포구성성분을 합성하기 위해 아주 소량의 유황을 감소시킵니다. 이에 반해 황산염 환원균은 에너지를 얻기위해 다량의 유황을 감소시키며, 대사 폐기물로 황화합물(sulphide)을 배출합니다. 황산염 환원균은 수소(H2) 대사작용의 산물로 황화수소(hydrogen sulphide)를 발생시키며, 황화수소(H2S)는 장 점막 어디에나 존재합니다.
황화수소(H2S)는 기체(gas)며 많은 양에서는 유독성이지만, 그러나 황화수소에 취약하지 않고 내성이 생긴 사람들에서 적은 양의 황화수소(H2S)는 안전합니다. 또한 염증성장질환 환자에서 황화수소(H2S)와 황산염 환원균이 더 많이 검출되었으며, 그러나 대장암 환자에서는 더 적게 검출되므로, 장내의 황화수소(H2S)가 장의 건강에 나쁜 영향뿐만이 아니라 유익한 영향도 끼치는 것으로 보입니다.
Are we getting enough sulfur in our diet?
Microbial pathways in colonic sulfur metabolism and links with health and disease.
Emerging role of hydrogen sulfide in colonic physiology and pathophysiology.
Hydrogen sulfide in gastrointestinal and liver physiopathology.
Impaired detoxication of hydrogen sulfide in ulcerative colitis?
Hydrogen sulfide is an endogenous potentiator of T cell activation.
어떤 장내균은 소화되지 않은 식품에 든 용해성 식이섬유소(soluble fiber)와 효소 저항성 전분(resistant starch)을 단쇄지방산들(short-chain fatty acids:SCFAs)로 바꾸어줍니다. 그 중 하나가 뷰티르산(butyric acid)이란 지방산(fatty acid)으로 대장의 건강에 유익한 대단히 중요한 작용을 합니다. 녹색의 바나나에는 많은 양의 효소 저항성 전분(resistant starch)이 들어 있으며, 이는 장 박테리아에 의해 뷰티르산(butyric acid)으로 전환될 수 있습니다.
버터와 파마산치즈(parmesan cheese) 같은 일부 식품에는 비교적 많은 뷰티르산(butyric acid)이 들어있습니다. 버터에는 3%-4%의 뷰티르산(butyric acid)이 들어있습니다. 곰부차(Kombucha)에도 역시 뷰티르산(butyric acid)이 들어있습니다. 그러나 버터에는 건강에 덜 유익한 장쇄지방산 (지방산을 결합하는 탄소사슬 길이가 긴 지방산) 역시 다량 함유하였으며, 버터 같은 우유에서 유래된 포화지방을 다량 섭취하는 것은 (홍화씨유 같은 불포화지방산은 무관함) 특정 박테리아, 특히 Bilophila wadsworthia라는 균이 전체 장내균의 약 6%에 이르도록 증식을 촉진시켜, 염증성장질환을 촉발시킬 수 있습니다.
Functional interactions between the gut microbiota and host metabolism.
Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice.
뷰티르산(butyric acid)은 장벽 상피 라이닝(lining)을 건강하게 유지하도록 돕고, 또한 염증성장질환 환자의 증상을 완화시켜줍니다. 뷰티르산(butyric acid)은 또한 대장암의 발병위험을 줄여주기도 합니다. 뷰티르산(butyric acid)은 대장 점막세포의 주요 에너지원(fuel)입니다. 대장 점막세포에서 세포막의 정확성(일관성) 유지를 위한 적절한 이온전달(ion transfer), 점막합성, 해독2단계(효소들이 독소에 작은 화학물질을 붙이는 접합과정) 및 지질합성은 뷰티르산 산화(butyrate oxidation)에 의존합니다. 그러므로 단쇄지방산(SCFA) 대사작용 의 이상은 염증성장질환 발병요인의 하나로 여깁니다.
황화수소(H2S)는 대장 점막세포에서 뷰티르산 산화(butyrate oxidation)를 억제하는 것으로 밝혀졌습니다. 연구보고에 의하면 활성화된 염증성장질환 환자에서는 관해(remission)상태의 환자에 비해 뷰티르산 산화(butyrate oxidation)가 크게 저하되는 것으로 나타났습니다. 관해상태의 환자에서는 정상적인 산화(oxidation)가 관찰되므로, 불완전한 단쇄지방산(SCFA) 산화는 염증성장질환의 주요 원인이라기 보다는, 질환으로 인한 결과로 보입니다. 염증성장질환 환자에서는 고밀도의 황산염환원균(sulfate reducing bacteria: SRB)과 황화수소(H2S)가 동반상승한다는 것이 지목되었습니다. 그러므로 황화수소(H2S)는 미토콘드리아에서 뷰티르산 산화(butyrate oxidation)를 억제하므로써, 근본적으로 대장 점막세포 에너지를 고갈시켜 대장점막에 잠재적 손상을 입힐 수 있습니다.
Intestinal microbiota in inflammatory bowel disease: friend of foe?
Butyrate and the colonocyte. Implications for neoplasia.
Butyrate and glucose metabolism by colonocytes in experimental colitis in mice.
Effect of butyrate enemas on the colonic mucosa in distal ulcerative colitis.
메티오닌(methionine)은 주로 계란, 생선, 붉은색 육류, 가공육 및 유제품에 더 많은 양이 들어있습니다. 한편, 식이에서 메티오닌의 고단위 섭취(하루 5-6 g)는 비타민 B를 적절히 섭취하더라도 혈중 호모시스테인(homocysteine) 수준을 증가시키는 것으로 확인되었습니다. 호모시스테인은 유황을 함유한, 단백질 구성원이 아닌 아미노산(non-proteinogenic amino acid)으로 메티오닌(methionine) 대사작용의 중간과정에 존재하는 대사산물입니다. 이러한 호모시스테인의 증가는 누구도 원치 않는 면역계의 활성화로, 내피세포에 혈중 단핵구(monocyte: 염증세포)의 부착이 증가되는 대가를 치러야 할 우려가 높아집니다. 높은 수준의 호모시스테인은 통증과 염증을 증가시킵니다.
더욱이, 한 연구에서는 궤양성대장염과 크론병으로 고통받는 환자의 대장점막에 호모시스테인 농도가 현저히 상승한 것이 관찰되었습니다. 염증성장질환 환자의 대장점막과 혈중 호모시스테인 수준의 상승은 궤양성대장염과 크론병의 발병기전에 역할을 하는 것으로 짐작됩니다.
The effects of sulfur amino acid intake on immune function in humans.
요약: 염증성장질환에 영양요소는 중요합니다. 현재 염증성장질환의 예방과 치료에 도움이 되는 것으로 여기는 요소들은 다음과 같습니다.
지놀짐(GinolZym)은 암모니아 및 신경독소의 잠재적 해독물질인 단쇄지방산(SCFA) 뷰티르산을 함유하고 있습니다. 뷰티르산은 단일성분으론 가장 많은 식이섬유 대사물입니다. 지놀짐은 장내 유익균의 형성을 촉진합니다. 더욱이 지놀짐은 대부분의 장내 유해균을 억제하는 효과가 있습니다.
전세계적으로 수백만명의 사람들이 가장 고통스러운 양대 소화기질환인 궤양성대장염(Ulcerative Colitis: UC)과 크론병(Crohn’s Disease: CD)으로 심히 고통받고 있습니다. 두 질환은 의학분류에서 염증성장질환(Inflammatory Bowel Disease: IBD)에 속합니다 (베체트병도 염증성장질환으로 분류).
염증성장질환에서 염증매개물질(inflammatory mediators)이 확인되었으며, 이들 매개물질들이 염증성장질환의 임상병리적 특징에서 중요한 역할을 한다는 믿을만한 증거들이 제시되었습니다. 그 결과는 정상적인 신체조직을 파괴하는 면역반응입니다. 그러나 염증성장질환이 자가면역질환(autoimmune disease)이라는 과학적 증거는 없습니다. 이는 단지 추정입니다. 염증성장질환의 발병원인은 아직까지 불분명합니다.
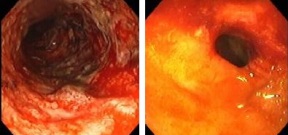 궤양성대장염과 크론병은 여러 장외 증상들(extraintestinal manifestations)이 공통적이나, 일부 장외 증상들은 한 질환에 더 자주 나타나는 경향을 보입니다(빈도의 차이). 궤양성대장염과 크론병은 일상생활을 어렵게하는 증상들(다량의 출혈성 설사, 복부통증, 체중감소 등)의 원인이며, 강력한 항염증/면역억제 약물에 장기간 의존하게 되고, 흔히 장 절제수술로 쇠약해지거나, 심지어 사망하기도 합니다. 궤양성대장염과 크론병은 별개의 질환이라기 보다는 단지 같은 발병원에 두 가지의 다른 증상처럼 보입니다.
궤양성대장염과 크론병은 여러 장외 증상들(extraintestinal manifestations)이 공통적이나, 일부 장외 증상들은 한 질환에 더 자주 나타나는 경향을 보입니다(빈도의 차이). 궤양성대장염과 크론병은 일상생활을 어렵게하는 증상들(다량의 출혈성 설사, 복부통증, 체중감소 등)의 원인이며, 강력한 항염증/면역억제 약물에 장기간 의존하게 되고, 흔히 장 절제수술로 쇠약해지거나, 심지어 사망하기도 합니다. 궤양성대장염과 크론병은 별개의 질환이라기 보다는 단지 같은 발병원에 두 가지의 다른 증상처럼 보입니다.
염증성장질환은 북부 유럽과 앵글로색슨 출신의 사람들에서 더 많이 발생하며, 지방보다는 도시지역에서 더 자주 나타납니다. 또한 궤양성대장염과 크론병은 모두 사무직 근로자에서 더 흔합니다. 염증성장질환의 빈도는 산업화의 물결과 동반 상승하였습니다. 이러한 고려사항들은 염증성장질환이 유전적소인과 환경적요인, 식습관, 오염, 공업용 화학물질에 노출, 태양광노출부족(비타민 D호르몬 부족), 감염, 만성 스트레스 및 면역기능의 이상을 포함한 여러 요인들의 복합적작용에 기인한 것임을 제시합니다.
장의 염증성(Inflammatory bowel) 증상은 위 또는 장에 이상이 생긴 질환이 아닙니다. 장은 단지 증상이 표출되는 위치입니다. 이 퇴행성질환(degenerative disease)의 진정한 근원은 균형이 깨진 신체방어시스템(imbalanced defense mechanism) 입니다. 따라서 염증성장질환 환자분은 면역계, 호르몬계, 소화기계, 신경계의 불균형을 시정해야만 하며, 그리하여 장 점막조직이 정상적으로 회복되고, 그로써 신체에서 다시 영양을 흡수할수 있고, 그리하여 스스로 치유되도록 만들어야 합니다.
Epithelial tight junctions in intestinal inflammation.
Do we really understand what the immunological disturbances in inflammatory bowel disease mean?
Intestinal bacteria and inflammatory bowel disease.
Role of reactive metabolites of oxygen and nitrogen in inflammatory bowel disease.
Investigating intestinal inflammation in DSS-induced model of IBD.
 장내세균총(gut flora)의 다양한 변화가 염증성장질환의 근본적인 원인일 것으로 다양하게 제시되고 있습니다. 예를 들면, 가공식품과 제과류에 풍부한 농축된 유지방(milk fats)은 장내세균의 분포를 바꾸어줍니다. 이러한 변화들은 복합미생물이지만 대부분이 유익균인 장내세균과 면역계 간의 민감한 휴전상태를 깨뜨릴 수 있습니다. 이러한 설정에서 유해균류의 증가는 조직을 손상시키는 제어되지 않는 면역반응을 촉발시킬 수 있으며, 이를 중단시키기 어려울 수 있습니다.
장내세균총(gut flora)의 다양한 변화가 염증성장질환의 근본적인 원인일 것으로 다양하게 제시되고 있습니다. 예를 들면, 가공식품과 제과류에 풍부한 농축된 유지방(milk fats)은 장내세균의 분포를 바꾸어줍니다. 이러한 변화들은 복합미생물이지만 대부분이 유익균인 장내세균과 면역계 간의 민감한 휴전상태를 깨뜨릴 수 있습니다. 이러한 설정에서 유해균류의 증가는 조직을 손상시키는 제어되지 않는 면역반응을 촉발시킬 수 있으며, 이를 중단시키기 어려울 수 있습니다.
장내 미생물생태계는 많은 다른 미세서식지(microhabitats)에서 식이에 의해 영향을 받을 수 있으며, 결과적으로 장대사작용에 필수적인 형태의 대사과정을 형성하게 됩니다 (육식위주와 채식위주의 식습관 간에는 장내세균분포와 장대사과정이 크게 달라집니다). 따라서 현재 관심의 초점은 염증성장질환에서 보여주는 염증(inflammation)에 모아집니다. 우리는 이들 질환의 발병위험을 높이는 유전적 소인의 교정에 관해서는 할 수 있는게 별로 없습니다. 그러나 이 같은 염증성장질환을 효과적으로 치료하기 위해 장내세균의 균형을 건강한 상태로 재구성할 수는 있습니다.
Current concepts of the intestinal microbiota and the pathogenesis of infection.
Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice.
Patients with inflammatory bowel disease exhibit dysregulated responses to microbial DNA.
The gut microbiota and mucosal T cells.
우리가 장내에 유해한 세균종류나 이스트(yeasts)를 지녔을때, 이러한 상태를 장세균총 이상(intestinal dysbiosis)이라고 부릅니다. 이처럼 장내세균의 자연적인 균형이 깨졌을 때, 유해균과 곰팡이는 장내에 그들의 독성체액(toxic humors)을 퍼뜨립니다. 이러한 현상은 여러 경로를 통해 나타납니다.
탄수화물 단당류(monosaccharides)와 이당류(disaccharides) 및 전체 지방(fats)의 고도 섭취는 염증성장질환인 궤양성대장염과 크론병의 발병위험을 지속적으로 증가시킵니다. 풍부한 채소섭취는 궤양성대장염의 위험을 줄여주지만, 풍부한 과일 및(또는) 식이섬유의 섭취는 크론병을 막아주는 것으로 나타났습니다. 궤양성대장염 발병율이 높은 지역의 현대적 식생활에서 중요한 변화의 하나는 유황(sulfur) 함유식품의 풍부한 섭취입니다. 장내 유황 재이용 펌프(sulfur salvage pump)에 의해 재처리되지 못한 유황은 대장으로 내려가 궤양성대장염 환자에서 훨씬 더 많이 존재하는 것이 확인되고, 특히 궤양성대장염의 발적확장(flare)과 관련된 탈황균(황산염 환원균: sulfate reducing bacteria)에 의해 일부 대사됩니다.
특정 영양소, 특히 비타민 D 수준의 저하 역시 궤양성대장염과 크론병 모두의 발병위험을 증가시킵니다. 일부 인공감미료(사카린과 슈크라로스) 역시 염증성장질환의 원인의 하나일 수 있습니다. 인공감미료는 유익균을 감소시키고, 장을 손상시키며, 손상부위로 균과 항원(antigen) 및 미세물질 침투의 원인이 됩니다.
Role of nutrition and microbiota in susceptibility to inflammatory bowel diseases.
Inflammatory bowel disease: role of diet, microbiota, life style.
Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier.
Etiology of inflammatory bowel disease: a unified hypothesis.
화학물질은 우리가 먹는 안전하지 못한 식품, 호흡하는 공기, 식수 및 목욕물을 통해 체내로 들어옵니다. 예를 들면 체내에서 발견되는 다이옥신(dioxin)의 거의 대부분은 오염된 식품의 섭취를 통해 들어온 것입니다. 그 발생원이 어디던 간에, 식품사슬(food chain) 어느 곳에서 들어오고, 우리가 먹는 식품으로 유입되는 경로가 만들어집니다.
대부분의 가공식품에 들어있는 무해한 것처럼 보이는 많은 식품첨가물들이 소화를 방해하고, 장내 유익균을 죽이거나 손상시킬 것입니다. 문제는 특히 이러한 식품들을 규칙적으로 섭취할 때의 경우입니다. 식품첨가물은 장을 자극하고, 장내의 pH를 바꾸거나 또는 다른 민감한 화학적균형을 깨뜨릴 수 있습니다.
점막 상피조직은 영양소와 세균, 독성물질을 포함한 외부환경 성분들과의 사이에 물리적, 기능적 차단벽을 형성합니다. 최근 연구보고는 건강한 장점막에서 발현되는 엘라핀(Elafin: 단백질 소화효소인 프로테아제 억제물질)이 염증성장질환 환자에서는 줄어든다는 결과를 보여줍니다. 엘라핀(Elafin)은 다형질의 항염증작용으로 조직의 손상을 억제합니다.
Interaction between food substances and the intestinal epithelium.
Food-grade bacteria expressing elafin protect against inflammation and restore colon homeostasis.
Therapeutic potential of human elafin.
Modifying the protease, antiprotease pattern by elafin overexpression protects mice from colitis.
알러지와 영양에 관련된 발병요인들 역시 상당히 연구에 초점을 두고 있습니다. 뒷배경에 치약을 발병원인으로 보는 개념의 일부로, 미세입자(microparticles)가 염증성장질환의 주요 촉발요인으로 더욱 광범위하게 제시되고 있습니다. 영국에서는 일인당 하루 약40 mg의 외인성 미세입자가 식품첨가물과 약물/보충제의 첨가제(excipients) 또는 치약성분을 통해 체내유입되는 것으로 확인되었습니다.
Past and current theories of etiology of IBD: toothpaste, worms, and refrigerators.
또한 장내에 크렙시엘라(Klebsiella pneumonia) 프로테우스 미라빌리스(Proteus mirabilis) 같은 유해균의 존재가 염증성장질환과 관련된 것으로 보입니다. 이들은 어떠한 균인가?
그람 음성균인 크렙시엘라(Klebsiella)는 폐렴, 혈액감염, 상처와 수술부위 감염, 뇌수막염 같은 여러 다른 감염의 원인일 수 있습니다. 건강한 사람은 대개 크렙시엘라(Klebsiella)에 감염되지 않습니다. 크렙시엘라(Klebsiella)는 사람과 사람간의 접촉을 통해(예, 환자와 환자간 감염된 손, 혹은 의료종사자, 혹은 다른 사람을 통해), 혹은 오염된 식품섭취에 의해 확산됩니다. 또한 크렙시엘라(Klebsiella)는 사람의 변에서도 발견됩니다.
프로테우스 미라빌리스(Proteus mirabilis)는 장내세균총의 일부로 발견될 수 있는 또다른 그람 음성균입니다. 이 균은 대체로 병원균은 아니나, 요로(urinary tract) 내의 요소(urea)에 접촉할 때 문제가 됩니다. 그곳에서 부터 감염이 신체 다른 부위로 확산될 수 있습니다. 프로테우스 미라빌리스는 매년 병원에서 수천명의 사람들에게 요로감염을 일으키는 원인균의 하나입니다. 또한 이러한 감염은 신장과 방광에서 결석을 만들 수 있습니다.
A possible link between Crohn’s disease and ankylosing spondylitis via Klebsiella infections.
장내세균총(gut flora)은 유전자변이농산물(GMO)에 의해 심대한 영향을 받습니다. 유전자변이농산물(GMO)은 유전자분할(gene splicing) 기술로 유전자 구조를 변화시킨 농산물입니다. 농장의 가축은 수년간 유전자변이농산물(GMO)로 사육됩니다. 이는 분명 질병을 일으키는 문제가 몇년내에 바로 나타나지는 않는다는 뜻입니다.
러시아의 과학자들은 캠벨 헴스터(번식율이 빠름)에게 미국 곡물회사 몬산토(Monsanto)의 유전자변이 대두를 2년간 먹였습니다. 여기서 알아야 할 것은 햄스터는 진화적으로 대두를 먹지 못하며, 이는 마치 몬산토의 옥수수를 먹인 소가 사실은 반추(되새김)동물이며, 자연적으로는 옥수수를 먹지 않는 것과 같습니다.
햄스터에게 3대에걸처 2년간 유전자변이 대두를 먹인 결과, 특히 유전자변이 대두를 최대한 섭취한 그룹에서 충격적인 결과를 보였습니다. 대부분의 유전자변이 대두를 먹인 햄스터는 3대까지 새끼를 갖는 능력이 사라졌습니다. 또한 이들은 저성장을 겪었고, 새끼들 중에 사망율이 높았습니다. 그리고 더욱 충격적인 것은 심지어 3대째의 햄스터들 중에는 아주 드물게 볼 수 있는 현상인 구강내 발모가 나타났으며, 분명 유전자변이 대두를 섭취한 햄스터에서 주로 나타났습니다.
연구진이 수컷 쥐에게 유전자변이 대두를 먹인 결과, 쥐의 고환이 분홍색에서 짙은색으로 바뀌었습니다.
A new example of ectopia: oral hair in some rodent species.
더욱이 한 보고서에서는 유전자변이 옥수수 또는 대두의 섭취가 실험용 쥐와 일반 쥐에서 중대한 장기손상, 특히 간과 신장의 손상을 초래한다는 결과를 보여줍니다. 아마도 심장과 비장(spleen), 또는 혈액세포 같은 다른 장기들도 역시 해로운 영향을 받을 것입니다.
://www.enveurope.com/content/pdf/2190-4715-23-10.pdf
유전자변이식품에 관한 가장 명백한 우려는 알러지반응(allergic reactions)의 위험입니다. 90% 이상의 식품 알러지는 식품 속의 특정 단백질에 대한 반응으로 나타납니다.
유전자변이식품에 대한 알러지반응은 장누수증후군(leaky gut syndrome)과 같은 문제를 초래할 수 있습니다. 장누수증후군은 장벽상피 라이닝(lining)의 염증과 라이닝(lining)의 미세융모가 손상되며 발생합니다. 장누수증후군은 만성피로와 우울증과도 연관되어 있습니다.
더욱이 유전자변이식품은 실제로 우리 소화기관내에 서식하는 균들의 일부가 되고, 체내에서 지속적으로 재생산 될 것입니다. 우리는 심지어 유전자변이식품 섭취를 중단한 후에도, 아마도 체내에서 생산된 유전자변이 단백질을 계속 지니게 될 것입니다. 만일 대부분의 유전자변이 작물에 주입된 항생물질 유전자(antibiotic gene)가 옮겨간다면, 새로운 항생제내성 질환이 창조될 수도 있습니다.
또한 살충을 위해 유전자변이작물에 주입되는 Bt독소(Bt toxins)는 토양 박테리아인 바실러스 투린지엔시스(Bacillus thuringiensis)로부터 분리한 독성단백질로 자연적인 해충방제에 사용되나, 우리의 장내세균을 살아있는 살충제로 만들 우려가 있습니다.
더욱이, 동물대상 연구에서는 식품의 DNA가 전신을 통해 장기로 들어갈 수 있다는 결과를 보였습니다. 만일 유전자변이식품의 유전자가 우리 고유의 유전자로 옮겨가게 되면 궤양성대장염이나 크론병 같은 문제가 초래될 수도 있습니다. 유전자변이식품은 우리의 소화기시스템을 바꿉니다. 소화기질환과 대장암의 통계적 증가는 유전자변이식품의 출현에 따라 직접 추적할 수 있습니다. 궤양성대장염이나 크론병은 심지어 수술 후에도 지속되며, 실제 유전자변이식품과 화학첨가물을 함유한 식품의 섭취를 중단할 때까지 더 악화됩니다. 궤양성대장염이나 크론병은 그곳에 우연히 생긴 것이 아닙니다.
아침식사대용 “내츄럴(천연)” 시리얼을 생산하는 몇몇 업체는 유전자변이 성분들을 그들의 제품에사용합니다. 미국 옥수수 작물의 약 1/2은 유전자변이 종자에서 자랍니다. 곡물 메이저 몬산토(Monsanto)는 전세계 유전자변이농산물 종자의 약 90%를 공급합니다. 세계적으로, 유전자변이는 무역이슈로 대두되고 있습니다. 그러나 미국은 자국의 바이오기술 산업의 보호를 원하고, 수출기반의 농산물분야를 위해 공격적으로 새로운 시장을 찾고 있습니다. 예를 들면, 유전자변이 농산물의 안전성에 관한 우려가 커짐에도, 한국에서 수입한 유전자변이 옥수수와 대두는 2010년도에 205만톤으로 전년도의 107만톤에 비해 무려 92%가 증가했습니다 (농수산식품부 통계자료). 최근 한국에서 조사된 보고서에서도 역시 염증성잘질환의 발병율과 유병율의 급격한 증가를 보여줍니다. 한국은 소아의 염증성잘질환 발병율 역시 급속히 증가하고 있습니다.
Genetically mhodified (GM) foods – renewed threat to Europe
대부분의 염증성잘질환 환자분은 구강건강과 구강세균총 (oral flora)이 그들의 치료에 얼마나 중요한지를 인식하지 못하고 있습니다. 불량한 구강건강상태와 유해 구강세균은 장부전(intestinal failure), 과민성대장증후군 및 다른 소화기질환을 초래할 수 있습니다. 유해 구강세균은 혈류로 들어갈 수 있으며, 다른 조직을 공격할 수 있습니다. 좋은 구강건강과 전신건강 사이의 연관성은 잘 알려졌습니다. 좋은 구강건강의 유지는 염증성장질환 환자분이 할 수 있는 가장 중요한 일의 하나입니다. 구강내에 유해 화학물질, 치약 (미세물질) 및 자극성분을 더이상 사용하지 말아야 합니다 (이들 대부분은 염증성장질환 증상을 더욱 악화시킬 수 있습니다).
Correlation network analysis applied to complex biofilm communities.
The oral microbiome in health and disease and the potential impact on personalized dental medicine.
Deep sequencing of the oral microbiome reveals signatures of periodontal disease.
Association between Selected Oral Pathogens and Gastric Precancerous Lesions.
만일 “우리가 먹는 것이 우리 몸을 만든다”고 한다면, 궤양성대장염과 크론병 환자분은 대부분 안전하지 못한 식품과 공장 사육된 육류, 유전자변이농산물을 섭취한 결과로 위험한 세균 잔존물이 남아있는 독성물질 하치장일 것입니다. 면역조절 자연치료제 지놀짐(GinolZym)+오랄짐(OralZym 및 OralZym-F)요법을 사용한 염증성장질환 환자분이 치료시작 3주만에 상당한 증상의 호전을 경험했습니다. 12주 까지는 거의 회복단계에 들어섰습니다. 지놀짐(GinolZym)은 크렙시엘라(Klebsiella pneumonia) 같은 그람 음성 유해세균에 대한 억제효능이 있습니다.
직장에 발생한 궤양성대장염 여성환자분 (26세)은 본 치료법 사용 전까지 수년간의 약물치료에도 매일 혈변을 보았습니다. 증상이 사라지기까지는 4개월이 걸렸습니다. 현재는 관해상태를 유지하며 지놀짐(GinolZym)+오랄짐(OralZym 및 OralZym-F)요법을 지속하고 있습니다. 다른 크론병 남성환자분은 다른 약물의 사용 없이 증상이 완전히 사라지기까지 3개월이 걸렸습니다.
종양세포의 비정상적인 대사작용은 이를 치료의 표적으로 활용하는 기회를 제공합니다. 종양세포는 정상세포조직에 비해 메티오닌(methionine)의 제한에 더욱 민감하며, 이를 메티오닌 의존 영양요구(methionine auxotrophy) 현상이라고 합니다. 메티오닌(methionine)은 포유동물의 대사작용에서 단백질 합성과 DNA의 메틸화, 폴리아민(polyamine) 생합성 같은 여러 핵심적 역할을 하는 필수아미노산의 일종이나, 체내에서 생성되지 못하므로 반드시 식이로 공급되어야만 합니다.
여러 암세포와 주요 종양들은 메티오닌(methionine)이 절대적으로 필요합니다. 종양세포에서 메티오닌(methionine) 의존성의 증가는 특정한 대사결함(metabolic defect)의 하나입니다. 메티오닌(methionine) 의존성에 관한 생화학적 기전이 광범위하게 연구되었으나, 근본적 기전은 아직까지 명확하지 않습니다.
메티오닌 고갈(methionine starvation)은 종양세포의 DNA 메틸화, 세포주기 진행, 폴리아민(polyamine)과 항산화물질의 생합성을 강력하게 조절할 수 있습니다. 그러므로 저 메티오닌(low methionine) 식이는 암의 증식, 특히 유방암, 대장암, 전립선암, 폐암을 비롯해 생존과 증식에 메티오닌 의존성을 보이는 다른 암들을 조절하는 중요한 전략의 하나일 것입니다. 이와는 반대로 정상세포는 외인성의 메티오닌 제한(methionine restriction)에 비교적 잘 견딥니다.
Targeting methionine auxotrophy in cancer: discovery & exploration.
Methionine dependency and cancer treatment.
Methionine restriction selectively targets thymidylate synthase in prostate cancer cells.
Induction of caspase-dependent and -independent apoptosis in response to methionine restriction.
 동물성 식품이 포함되지 않은 채식(vegan diet)에는 메티오닌(methionine)이 적습니다. 식물성 단백질은 동물성 단백질에 비해 메티오닌 함량이 적은 경향이 있습니다. 예를 들면 밀과 감자는 계란과 닭고기에 비해 각각 메티오닌(methionine) 함량이 약 1/4 입니다. 더욱이 운동과 함께하는 저지방(low-fat) 채식은 전신의 인슐린과 혈중 IGF-1(인슐린유사성장인자-1) 수준을 낮춰주므로 암치료 효능의 향상을 기대할 수 있습니다. IGF-1과 암발병 위험 간의 관련은 이미 잘 알려졌습니다. IGF-1의 정상적인 기능은 세포분열 촉진으로, 특히 어린이 발달기에 기능을 합니다.
동물성 식품이 포함되지 않은 채식(vegan diet)에는 메티오닌(methionine)이 적습니다. 식물성 단백질은 동물성 단백질에 비해 메티오닌 함량이 적은 경향이 있습니다. 예를 들면 밀과 감자는 계란과 닭고기에 비해 각각 메티오닌(methionine) 함량이 약 1/4 입니다. 더욱이 운동과 함께하는 저지방(low-fat) 채식은 전신의 인슐린과 혈중 IGF-1(인슐린유사성장인자-1) 수준을 낮춰주므로 암치료 효능의 향상을 기대할 수 있습니다. IGF-1과 암발병 위험 간의 관련은 이미 잘 알려졌습니다. IGF-1의 정상적인 기능은 세포분열 촉진으로, 특히 어린이 발달기에 기능을 합니다.
더욱이, 식물은 메티오닌(methionine)에 대해 기능적 길항물질(functional antagonist)로 작용하는 필수아미노산 글라이신(glycine)의 풍부한 공급원입니다. 콩류와 대두를 적당히 섭취하는 통식품 채식(whole-food vegan diets)에 충분한 양의 과일을 곁들이면 건강유지에 충분한 영양을 공급하면서도, 메티오닌(methionine)은 크게 낮출 수 있습니다. 메티오닌(methionine)은 아미노산 시스테인(cysteine), L-카르니틴(L-carnitine), 타우린(taurine)의 중간 전구물질(precursor)이므로, 메티오닌(methionine) 식이제한을 실행중인 암환자분은 다른 공급원을 통해 이들 영양소를 보충해야만 할 것입니다.
메티오닌(methionine)이 풍부한 10대 식품: 계란, 생선, 가금류, 육류, 어패류, 코타지 치즈(cottage cheese), 땅콩, 통 렌틸콩(whole lentils), 요거트(yoghurt)
Association between Circulating Levels of IGF-1 and IGFBP-3 and Lung Cancer Risk: A Meta-Analysis.
Insulin-like growth factor-1 and childhood cancer risk.
필수아미노산 메티오닌(methionine)의 대사산물인 호모시스테인(homocysteine)은 메티오닌(methionine)에서 메틸기가 빠진(demethylated) 아미노산입니다. 호모시스테인(homocysteine)은 메티오닌(methionine)이 대사되어 아미노산 시스테인(cysteine)과 타우린(taurine)으로 생합성되는 중요한 중간과정에 존재합니다. 호모시스테인(homocysteine)은 정상적으로 두 가지 생화학적 경로를 통해 대사됩니다; 한가지는 재 메틸화(re-methylation)로 호모시스테인(homocysteine)이 다시 메티오닌(methionine)으로 전환되는 것입니다. 또 다른 한가지는 황전환작용(trans-sulfuration)으로 호모시스테인(homocysteine)이 시스테인(cysteine)과 타우린(taurine)으로 전환되는 것입니다.
재 메틸화(re-methylation)는 주로 메틸전달효소가 보조인자인 비타민 B12(cobalamin)와 함께 작용해 엽산회로(folate cycle)에서 활성화된 형태의 엽산인 MTHF(methyltetrahydrofolate)로부터 메틸기를 이동시켜 붙여주므로써 이루어집니다. 예를 들어, 만일 엽산결핍으로 이러한 재생이 발생하지 못하면, 체내에 호모시스테인(homocysteine)이 축적됩니다. 주로 간과 신장에서 활성화되는 두 번째의 재 메틸화(re-methylation) 경로는 메틸 공여체(methyl donor)로 베타인(betaine, trimethylglycine)이 이용됩니다. 황전환작용(trans-sulfuration) 경로에는 두 번의 효소 반응이 필요하며, 활성화된 비타민 B6 (pyridoxal-5-phospate)가 보조인자로 두 번 모두 필요합니다.
호모시스테인(homocysteine)은 유황함유 아미노산입니다. 호모시스테인(homocysteine)이 과도하게 생성되고 메티오닌(methionine) 또는 시스테인(cysteine)으로 바로 전환되지 못하면, 엄격하게 제어되는 세포환경에서 혈액으로 배출됩니다. 혈액에서 과잉 호모시스테인(homocysteine을 제거하는 것은 간과 신장의 역할입니다. 호모시스테인(homocysteine)은 혈관과 다른 세포에 손상을 끼치는 것으로 알려졌습니다. 호모시스테인(homocysteine)과 심장질환의 연관성은 잘 알려졌습니다. 이것이 호모시스테인(homocysteine)을 훌륭한 항 혈관신생(anti-angiogenesis) 성분으로 만들어 줄 것입니다.
최근 연구보고는 호모시스테인(homocysteine)이 VEGF/VEGFR, Akt 및 ERK1/2의 억제를 통해 혈관신생(angiogenesis)을 억제한다는 것을 보여줍니다. VEGF(혈관내피세포성장인자)는 당단백(glycoprotein)의 일종으로 특정한 내피세포의 성장촉진인자로 작용합니다. 암세포와 다른 세포에서 분비되는 VEGF는 종양 속으로 혈관이 자라도록 촉진하며, 그리하여 종양이 커지고 대부분 전이가 되도록 만듭니다. 또한 VEGF는 혈관내피세포에서 생존과 증식 경로를 활성화시킵니다. VEGF는 또한 백혈병세포의 주요 성장인자입니다.
VEGF 리간드(ligands)는 특정한 VEGF 수용체(VEGFR)와 결합하여 그들의 혈관신생 효과를 매개하고, 수용체의 이합체화(dimerization)와 이차 신호전달이 이루어집니다. VEGF 수용체가 혈관내피세포 표면에 존재하는 것은 잘 알려졌지만, 종양세포에도 역시 VEGF 수용체가 발현된다는 것이 연구 보고되었습니다. AKT는 모든 암과 백혈병의 마스터 스위치이며, ERK1/2의 활성화는 일반적으로 암세포의 생존을 촉진합니다. 만일 이들 효소의 활성화를 억제할 수 있다면 암과 백혈병은 사라질 것입니다. 호모시스테인(homocysteine)은 단지 심장과 혈관에 나쁜 것만은 아닙니다. 분명 암세포에도 독성으로 작용합니다.
The methionine-homocysteine cycle and its effects on cognitive diseases.
Homocysteine-impaired angiogenesis is associated with VEGF/VEGFR inhibition.
종양 내 혈관은 비정상적이며, 실제 매우 불안정한 상태입니다. 그러므로 이런 형태의 항암식이요법이 효과적이기 위해서는 메티오닌(methionine)의 감축과 호모시스테인(homocysteine)의 증가가 모두 필요합니다. 호모시스테인(homocysteine)은 단지 지속되는 기간 동안 종양의 혈관에 손상을 일으키는 대사물입니다.
불행하게도, 커큐민(curcumin)은 호모시스테인(homocysteine) 증가로 인한 혈관내피세포의 기능이상을 막아주는 것으로 확인되었습니다. 커큐민(curcumin)은 호모시스테인(homocysteine)의 독성영향을 차단하는 것으로 보입니다. 그러므로 메티오닌(methionine)을 제한하는 암 식이요법에서 커큐민(curcumin)의 사용은 권하지 않습니다.
Niacin treatment increases plasma homocyst(e)ine levels.
Curcumin blocks homocysteine-induced endothelial dysfunction in porcine coronary arteries.
메티오닌(methionine)의 합성이나 재처리를 막아주는 효소 메티오니나제(methioninase 또는 methionine gamma-lyase, L-methionine gamma-lyase)는 특히 세포내부, 외부의 메티오닌(methionine)을 분해하므로써, 종양세포의 성장을 강력히 억제하고 종양세포의 자멸사(apoptosis)를 유도할 수 있습니다. 그러나 정상세포에는 영향을 끼치지 않는 것으로 확인되었습니다. 그러므로 메티오니나제(methioninase)는 종양의 세포분열을 중단 또는 지연시키는 주요한 기능을 합니다. 혈중 메티오닌 수준을 낮워주는 효소 메티오니나제(methioninase)의 적용은 또 다른 유용한 종양 성장억제 전략입니다.
Anticancer efficacy of methioninase in vivo.
 비터멜론(bitter melon: Momordica charantia)은 박과(오이, 호박 및 수박) 식물의 일원입니다. 비터가드(bitter gourd) 또는 야생오이(wild cucumber)라고도 불리는 비터멜론 열매는 열대 및 아열대 기후에서 성장합니다. 비터멜론은 높은 치료적 효용가치를 지닌 영양이 풍부한 식물입니다. 비터멜론은 식품으로 그리고 제2형 당뇨와 암, 감염질환, 에이즈(HIV), 월경장애 및 면역질환의 치료를 위한 치료제로도 이용됩니다.
비터멜론(bitter melon: Momordica charantia)은 박과(오이, 호박 및 수박) 식물의 일원입니다. 비터가드(bitter gourd) 또는 야생오이(wild cucumber)라고도 불리는 비터멜론 열매는 열대 및 아열대 기후에서 성장합니다. 비터멜론은 높은 치료적 효용가치를 지닌 영양이 풍부한 식물입니다. 비터멜론은 식품으로 그리고 제2형 당뇨와 암, 감염질환, 에이즈(HIV), 월경장애 및 면역질환의 치료를 위한 치료제로도 이용됩니다.
비터멜론의 씨와 열매 그리고 전체식물에서 다음과 같은 유래 화합물들이 분리, 보고되었습니다.
비터멜론 추출물은 혈당과 체지방을 낮춰주는 성분임이 이미 연구를 통해 알려졌습니다. 비신(Vicine), 카란틴(Charantin), 폴리펩티드-P(Polypeptide-P)를 포함한 비터멜론에 들어있는 성분들은 간과 근육, 그리고 지방세포에서 혈당의 흡수와 글리코겐 합성을 증가시키고, 내당능(glucose tolerance)을 개선합니다.
제2형 당뇨병 환자분들은 그들의 혈중 포도당을 근육에서 에너지로 변환시키는 능력에 이상이 생긴 것입니다. 이것은 일부는 인슐린을 충분히 생산하지 못하는 것이 원인이며, 일부는 근육세포나 지방세포에서 인슐린을 효과적으로 이용하지 못하는 “인슐린 저항성”현상이 원인입니다.
연구보고에서는 비터멜론 추출물이 손상된 베타세포(beta-cells)를 복구하고, 인슐린 수준을 높여주며, 또한 인슐린 민감성을 강화시킨다는 결과를 보여줍니다. 비터멜론 추출물은 장에서 당의 분해작용을 하는 효소 글루코시다아제 (glucosidase) 및 이당류분해효소 디사카리다아제(disaccharidases)를 억제하여 장에서의 당 흡수를 억제합니다.
Bitter gourd (Momordica Charantia): A dietary approach to hyperglycemia.
Effects of Momordica charantia on insulin resistance and visceral obesity in mice on high-fat diet.
Wild bitter gourd improves metabolic syndrome: a preliminary dietary supplementation trial.
세포내 에너지상태를 감지하는 효소 AMPK (AMP-activated protein kinase)는 세포내 에너지가 소모될 때 활성화되며, 반대로 에너지 공급이 과잉될 때는 억제되어 에너지 항상성을 유지시키는 연료센서(계측기) 역할을 합니다. AMPK는 간과 근육, 지방조직 같은 특정한 대사작용을 하는 조직에서 지질과 콜레스테롤 및 혈당의 대사를 조절합니다. 이러한 작용 때문에 제2형 당뇨병 환자들의 치료에서 효소 AMPK를 핵심적인 치료표적으로 삼게됩니다. AMPK의 활성화는 복합적인 기전을 통해 인슐린 감수성을 호전시킵니다. 에너지(ATP)의 고갈에 의해 AMPK가 일단 활성화되면, 대사성 효소를 직접 인산화시키고, 유전자 발현에 영향을 끼침으로써 ATP를 생산하는 과정인 동화작용은 촉진하고, ATP를 소비하는 과정인 이화작용은 억제하는 역할을 합니다.
운동을 하면 근육에서 AMPK를 활성화시키며, 이는 결과적으로 체내에서 순환하는 혈당이 세포조직으로 흡수되는데 매우 중요한 단계인 당 수송체(glucose transporters)의 세포 표면으로의 이동을 매개합니다. 이것이 바로 제 2형 당뇨병 환자분에게 정상적인 치료 프로그램의 일환으로 운동을 권하는 이유입니다. 비터멜론 추출성분은 운동이 AMPK를 활성화시키는 것과 매우 유사한 작용을 합니다. 제 2형 당뇨병 치료제로 광범위하게 사용되는 메트포민(Metformin) 역시 AMPK를 활성화시킵니다. 메트포민(Metformin)은 중세시대에 당뇨병치료에 사용된 프랜치 라일락(Galega officinalis)의 활성성분인 구아니딘(guanidine)에서 유래된 합성약물입니다.
AMP-activated protein kinase: balancing the scales.
Antidiabetic potentials of Momordica charantia: multiple mechanisms behind the effects.
AMPK는 대사성 종양억제자(matabolic tumor suppressor)입니다. AMPK의 활성이 대부분의 생합성 과정을 억제하고 세포주기(cell cycle)를 차단하는 요인이기 때문에, 세포증식억제성(cytostatic)과 종양억제자(tumor suppressor) 효과도 역시 갖고 있습니다. 더욱이, AMPK는 모든 암의 약 50%에서 돌연변이가 나타나는 그 유명한 종양억제 단백질인 P53을 활성화시킵니다. 암에서 흔히 나타나는 P53의 돌연변이 또는 기능상실은 종양세포가 다양한 세포자멸사를 유발할 수 있는 자극(apoptotic stimuli)에 대해 저항하도록 만듭니다.
AMPK as a metabolic tumor suppressor: control of metabolism and cell growth.
The LKB1-AMPK pathway: metabolism and growth control in tumour suppression.
AMPK Promotes p53 Acetylation via Phosphorylation and Inactivation of SIRT1 in Liver Cancer Cells.
 AMPK의 활성을 증가시키는 능력으로만 본다면 메트포민(Metformin)은 항암작용을 하는 약물입니다. 그러나 불행하게도 처방약물인데다 여러 형태의 심각한 부작용이 있습니다. 비터멜론 추출물은 거의 부작용이 없으며, 사용을 원하면 누구나 손쉽게 구입할 수 있습니다. 더욱이 최근에는 비터멜론 추출물이 돌연변이유발, 암유전자발현, 세포주기정지(cell cycle arrest), 세포자멸사(apoptosis), 종양생성 및 전이에 관련된 일련의 다양한 생물학적 경로에 영향을 미쳐 항암작용을 하는 성분을 함유한 것으로 밝혀졌습니다. 이러한 발견은 비터멜론 추출물이 유방암, 간암, 전립선암, 대장암 및 백혈병을 포함함 다양한 종류 암의 예방 또는 치료에 적용될 수 있음을 제시합니다. 그러나 이러한 치료적 효능을 만드는 것이 어떤 특정한 알카로이드(alkaloids)나 폴리펩티드(polypeptides), 또는 이들 성분의 복합적인 작용인지는 아직까지 확인되지 않았습니다.
AMPK의 활성을 증가시키는 능력으로만 본다면 메트포민(Metformin)은 항암작용을 하는 약물입니다. 그러나 불행하게도 처방약물인데다 여러 형태의 심각한 부작용이 있습니다. 비터멜론 추출물은 거의 부작용이 없으며, 사용을 원하면 누구나 손쉽게 구입할 수 있습니다. 더욱이 최근에는 비터멜론 추출물이 돌연변이유발, 암유전자발현, 세포주기정지(cell cycle arrest), 세포자멸사(apoptosis), 종양생성 및 전이에 관련된 일련의 다양한 생물학적 경로에 영향을 미쳐 항암작용을 하는 성분을 함유한 것으로 밝혀졌습니다. 이러한 발견은 비터멜론 추출물이 유방암, 간암, 전립선암, 대장암 및 백혈병을 포함함 다양한 종류 암의 예방 또는 치료에 적용될 수 있음을 제시합니다. 그러나 이러한 치료적 효능을 만드는 것이 어떤 특정한 알카로이드(alkaloids)나 폴리펩티드(polypeptides), 또는 이들 성분의 복합적인 작용인지는 아직까지 확인되지 않았습니다.
Momordica charantia leaf extract suppresses rat prostate cancer progression in vitro and in vivo.
Bitter gourd (Momordica charantia): a potential mechanism in anti-carcinogenesis of colon.
Glycosidic inhibitors of melanogenesis from leaves of Momordica charantia.
In vivo antitumor activity of the bitter melon (Momordica charantia).
대개 악성종양에는 약제에 감수성이 높은 악성세포들과 약제에 저항성(내성)을 지닌 악성세포들이 서로 혼합되어 있습니다. 항암화학요법은 약제에 감수성이 높은 악성세포들은 죽이지만, 그러나 약제에 내성을 지닌 상당 수의 악성세포들은 죽지 않고 살아남게 됩니다. 결국 종양이 다시 자라기 시작하지만 이제는 남아있던 악성세포들은 모두 내성을 지녔으므로, 항암화학요법은 실패하게 됩니다. 내성은 종양세포 세포막 내에서 항암약물을 세포외부로 활발히 배출시키는 “펌프(pump)” 역할을 하는 최소 2개의 암 세포막 분자의 존재와 연관되어 있습니다.
이것이 바로 종양세포가 약물의 독성효과 또는 세포의 핵(nucleus)이나 세포질(cytoplasm) 내의 분자작용(molecular processes)을 피하여 살아남도록 허용하는 것입니다. 암에서 흔히 발견되는 것으로 P-당단백(P-glycoprotein)과 소위 다제내성단백질(multidrug resistance–associated protein: MRP)이라고 하는 항암제 내성을 부여하는 2가지 펌프(pump)가 있습니다. P-당단백(P-glycoprotein)이 매개하는 모든 항암제에 대한 내성(다제내성:MDR)은 많은 암에서 항암화학요법의 효능을 차단하는 주요 장애물입니다. 반가운 소식은 비터멜론 추출물이 P-당단백 역시 억제하므로, P-당단백이 매개하는 배출을 억제함으로써 약물의 효능을 바꿀수 있다는 것입니다.
비터멜론은 전통적으로 약(medicine)과 식품으로써 역할을 해왔습니다. 우리가 아는 바로는 정상적인 야채식품으로 사용되는 비터멜론에 독성이 보고된 적은 전혀 없습니다. 그러나 시중에서 구입가능한 고용량의 비터멜론 추출물은 다른 어떤 폴리페놀성분(polyphenolics)의 과다복용시처럼 어떤 형태의 독성부작용을 만들 수도 있습니다. 또한 비터멜론 씨의 껍질은 어린이에게는 구토와 설사 및 심하면 사망에 이르게 까지 하는 독성의 원인이 될 수도 있습니다. 씨의 섭취는 급성의 혈액성 빈혈증, 특히 G6PD(Glucose 6-phosphate dehydrogenase)라는 적혈구의 효소가 모자라는 사람들에서는 급성빈혈증을 일으킬 수 있습니다. 또한 비터멜론은 혈당강하제를 복용시에는 혈당강하 가중효과를 만들 수도 있으므로 이런 경우는 전문가와 상의를 하는 것이 좋습니다.
 가장 순도 높은 자연산 비터멜론 추출물을 발효숙성처리하여 생체이용성(bioavailability)을 극대화하도록 개발된 자연치료제가 비엠짐(BM-Zym)입니다. 그러나 여기에 사용된 발효법은 일반적인 발효법과는 크게 다릅니다. 이것은 에너지가 풍부한 고분자의 유기체를 저분자로 분해하는 효소가 포함된 일련의 과정이며, 식물성식품 중에 종류와 부위에 따라 자연적으로 존재하는 독성의 제거와도 관련되었습니다. 자연성분의 섭취를 통해 원하는 효과를 얻는 것은 그 성분들의 생체이용성(bioavailability)에 달려있습니다.
가장 순도 높은 자연산 비터멜론 추출물을 발효숙성처리하여 생체이용성(bioavailability)을 극대화하도록 개발된 자연치료제가 비엠짐(BM-Zym)입니다. 그러나 여기에 사용된 발효법은 일반적인 발효법과는 크게 다릅니다. 이것은 에너지가 풍부한 고분자의 유기체를 저분자로 분해하는 효소가 포함된 일련의 과정이며, 식물성식품 중에 종류와 부위에 따라 자연적으로 존재하는 독성의 제거와도 관련되었습니다. 자연성분의 섭취를 통해 원하는 효과를 얻는 것은 그 성분들의 생체이용성(bioavailability)에 달려있습니다.
거의 모든 자연성분들이 섭취를 해도 기대했던 효과를 얻지 못하는 것은 정상적인 소화과정에서 생체이용성(bioavailability)이 크게 떨어지기 때문이며, 설령 이들 성분의 흡수를 돕기 위해 다른 흡수촉진성분을 함께 사용한다 해도 생체이용성(bioavailability)이 촉진되지는 않습니다. 비터멜론에서 추출된 활성성분의 생체이용성이 촉진되기해서는 반드시 장점막 차단벽(intestinal barrier)을 통과해야만 합니다.
비엠짐(BM-Zym)의 생리활성성분들(biologically active constituents)은 가장 높은 수준의 생체이용성과 효능을 유지하고 있습니다. 비엠짐(BM-Zym)은 가장 높은 수준의 고순도의 추출물일뿐 아니라, 비터멜론 전체식물의 천연적 균형을 이룬 모든 활성성분을 제공하므로 시너지효과를 유지, 강화하며, 비발효, 비농축된 비터멜론 열매에 비해 훨씬 더 생체에 잘 동화되고(assimilable) 또한 신속히 작용합니다.
500 mg, 120정(발효된 비터멜론 전체 열매 추출물: 비터 성분 20%로 배당체 모모디코시드(Momordicosides)와 카란틴(Charantin)-100 mg 함유, 100% 친환경, 100% 천연 발효성분)
권장복용량 하루 2,000 mg (500 mg x 4회). 필요시 복용량을 증량하여 조절가능.