신체에서 아연(zinc)의 역할은 매우 다양합니다. 그 중에서도 아연은 면역기능을 향상시키고, 치유과정에 중요한 역할을 하며, 건강한 뼈의 형성에 필요합니다. 잘 알려지지는 않았지만 이와 대등한 필수적인 아연의 역할로는 수 백 가지 효소의 구성을 돕고, 유전자 전사(gene transcription) 및 RNA와 DNA대사를 보조하는 것이 포함됩니다. 아연은 뇌, 신장, 근육, 간 및 뼈조직에 존재합니다. 하지만 아연은 눈과 남성의 전립선(prostate gland)에 가장 많이 존재합니다. 전립선 내에는 다른 연부조직(soft tissues)에 비해 10배나 많은 아연이 존재합니다. 아연은 정상적인 전립선의 기능에 매우 중요한 것으로 알려졌습니다.
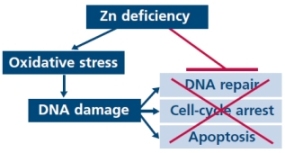 아연은 산화적스트레스로부터 세포조직을 보호하고 DNA의 수리를 돕는데 필수적입니다. 따라서 아연결핍은 산화적스트레스와 DNA의 손상을 증가시킵니다. 암화된 전립선조직에는 정상조직에 비해 아연수치가 현저하게 감소한다는 것이 확실해졌으며, 그러므로 전립선암 세포는 높은 수치의 아연축적이 불가능합니다. 전립선은 대량의 시트레이트(citrate:구연산)을 생산하고 분비하는 독특한 기관입니다. 시트레이트와 철분(iron)은 모든 기관의 대사에 필수적이며, 세포와 신체적 수준에서 시트레이트와 철분을 조절하는 것은 정상적인 생리기능과 생존에 대단히 중요합니다.
아연은 산화적스트레스로부터 세포조직을 보호하고 DNA의 수리를 돕는데 필수적입니다. 따라서 아연결핍은 산화적스트레스와 DNA의 손상을 증가시킵니다. 암화된 전립선조직에는 정상조직에 비해 아연수치가 현저하게 감소한다는 것이 확실해졌으며, 그러므로 전립선암 세포는 높은 수치의 아연축적이 불가능합니다. 전립선은 대량의 시트레이트(citrate:구연산)을 생산하고 분비하는 독특한 기관입니다. 시트레이트와 철분(iron)은 모든 기관의 대사에 필수적이며, 세포와 신체적 수준에서 시트레이트와 철분을 조절하는 것은 정상적인 생리기능과 생존에 대단히 중요합니다.
 전립선암에서는 시트레이트를 생산하는 정상적인 분비상피세포가 시트레이트를 산화시키는 (citrate-oxidizing) 악성세포로 대사적 변환이 진행됩니다. 미토콘드리아 아코니타제(m-aconitase)라는 효소의 작용은 전립선의 악성화에 필수적인 이러한 변환된 시트레이트 대사에 연관된 중요과정이며, 이러한 변환은 세포의 활성을 강화시키기 위해 시트레이트가 (재)유입되고, 대사물로 이용되는 것일 가능성도 있습니다. 더욱이, 아연은 정상적으로는 시트레이트 산화 억제제이므로, 전립선암에서 아연의 감소는 전립선암 환자의 분비상피세포에서 시트레이트 분비가 감소되는 원인일 수도 있습니다. 전립선세포에 의한 시트레이트 산화방지는 시트레이트 순 생산능력을 유지시키는 것과 핵심적 관련이 있습니다. 이러한 대사적 효과는 전립선세포에서 아연수준의 저하가 시트레이트 산화비율을 높이고, 이는 가용할 수 있는 에너지를 증가시키고, 전립선세포의 악성화와 종양의 증식에 기여하는 것 처럼, 암세포에서 에너지대사의 변환 및 에너지원인 ATP(아데노신삼인산) 생산의 변환을 의미합니다.
전립선암에서는 시트레이트를 생산하는 정상적인 분비상피세포가 시트레이트를 산화시키는 (citrate-oxidizing) 악성세포로 대사적 변환이 진행됩니다. 미토콘드리아 아코니타제(m-aconitase)라는 효소의 작용은 전립선의 악성화에 필수적인 이러한 변환된 시트레이트 대사에 연관된 중요과정이며, 이러한 변환은 세포의 활성을 강화시키기 위해 시트레이트가 (재)유입되고, 대사물로 이용되는 것일 가능성도 있습니다. 더욱이, 아연은 정상적으로는 시트레이트 산화 억제제이므로, 전립선암에서 아연의 감소는 전립선암 환자의 분비상피세포에서 시트레이트 분비가 감소되는 원인일 수도 있습니다. 전립선세포에 의한 시트레이트 산화방지는 시트레이트 순 생산능력을 유지시키는 것과 핵심적 관련이 있습니다. 이러한 대사적 효과는 전립선세포에서 아연수준의 저하가 시트레이트 산화비율을 높이고, 이는 가용할 수 있는 에너지를 증가시키고, 전립선세포의 악성화와 종양의 증식에 기여하는 것 처럼, 암세포에서 에너지대사의 변환 및 에너지원인 ATP(아데노신삼인산) 생산의 변환을 의미합니다.
아연 전달단백질(zinc transporter)인 ZIP1의 발현에 영향을 미치는 유전적인 변이는 이러한 대사적 변환과 연관되었습니다. 첫째로 모든 세포의 세포내 아연수준은 외부소스(예, 세포간 액체)로부터 아연흡수를 담담하는 아연전달 단백질의 존재에 의존합니다. 이런 유전적/대사적 관계는 악성세포의 시트레이트 대사, 생체에너지 생성, 세포증식 및 침윤능력에 중요한 결과를 가져옵니다. 하지만, 고도로 특화된 이들 전립선세포와는 반대로 대부분 포유동물 세포는 아코니타제(m-aconitase) 활성과 시트레이트 산화를 억제한다면 생존할 수가 없습니다.
Zinc deficiency alters DNA damage response genes in normal human prostate epithelial cells.
Zinc in specialized secretory tissues: roles in the pancreas, prostate, and mammary gland.
Zinc is decreased in prostate cancer: an established relationship of prostate cancer!
Metabolic regulation of citrate and iron by aconitases: role of iron-sulfur cluster biogenesis.
Mitochondrial aconitase and citrate metabolism in malignant and nonmalignant human prostate tissues.
Zinc blocks gene expression of mitochondrial aconitase in human prostatic carcinoma cells.
Zinc as an anti-tumor agent in prostate cancer and in other cancers.
아연결핍은 전세계적으로 매우 보편적입니다. 노화와 관련된 면역기능 저하는 이러한 아연결핍 관련 증상과 유사하며, 노년층은 중등도의 아연결핍에도 매우 취약합니다. 아연결핍의 가장 흔한 원인은 식이와 관련되었으며, 아울러 간질환, 신장질환, 당뇨병, 겸상적혈구질환(sickle cell disease) 같은 증상 및 많은 다른 질환들 역시 아연흡수를 억제함으로써 아연수준을 크게 저하시킬 수 있습니다. 체내에서 만성적인 아연수준의 저하는 발기부전, 성적성숙(sexual maturation)억제, 우울증, 피부병변, 인지능력 손실, 탈모, 면역력손상을 포함한 많은 다른 증상으로 나타납니다. 또한 아연결핍은 악성세포의 발생과 진행에 중요한 요인이며, 그러므로 다양한 여러 종류의 암, 즉 전립선암, 대장암, 췌장암, 식도암, 두경부암 같은 암의 예방과 치료에 아연의 보충이 효과적일 수 있습니다.
아연결핍은 선천(내재)면역반응과 적응면역반응 모두를 심각하게 훼손시키는 원인이며, 또한 염증 매개 질환과 암 발생 위험을 증가시킬 수 있는 만성 전신성 염증반응을 촉진합니다. 특정 신체기관에서의 염증상태가 암 위험을 증가시킨다는 것은 매우 확실해졌습니다. 또한 역학적으로 염증과 관련되지 않은 악성종양이라도 종양미세환경 내에 염증성분이 존재합니다.
대사적 요인들과 안드로겐(androgens)은 아연결핍, 아디포카인(비만세포 분비물질) 작용, 만성염증, 시트레이트 대사, 지방산 대사, 인슐린성장인자 신호경로(IGF signalling)를 포함한 복합적인 기전을 통해 전립선암의 발생을 촉진하는 것으로 보입니다. 그러므로 진행된 전립선암에서 만성염증의 치료는 중요한 치료의 표적임을 의미합니다.
Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability.
Zinc and its role in age-related inflammation and immune dysfunction.
Obesity, metabolic syndrome, and prostate cancer.
Are Toll-like receptor gene polymorphisms associated with prostate cancer?
Prostate cancer and inflammation: the evidence.
Advanced prostate cancer: reinforcing the strings between inflammation and the metastatic behavior.
전사인자 NF-κB는 천연(내재)면역/염증반응의 핵심 지휘자입니다. NF-κB는 종양의 성장과 전이, 혈관신생에 관련된 여러 유전자의 발현을 조절합니다. A20은 아연과 결합된 단백질(zinc finger protein)의 하나며, A20 유전자는 NF-κB에 의해 유도됩니다. A20은 NF-κB와 염증을 억제하는 중요한 역조절인자(negative regulator)입니다. 이는 세포에서 지속적인 NF-κB 반응을 억제하는 피드백(feedback) 반응이며, 실험에서 A20이 결핍된 쥐는 통제되지 않는 자발성 염증이 여러 기관에 나타나기 때문입니다. 또한 최근 연구보고에서는 A20이 B세포 림프종에서 활성화되지 않는 종양억제인자라는 결과룰 보였습니다. 아연은 A20의 유도를 통해 NF-κB가 조절하는 염증성 사이토카인(cytokines)의 생성을 억제합니다. 또한 아연은 NF-κB 억제를 통해 전립선암 세포의 세포자멸사(apoptosis)에 대한 민감도를 높여줍니다. 아연의 보충은 NF-κB의 활성을 감소시킵니다.
Zinc and inflammatory/immune response in aging.
A20: central gatekeeper in inflammation and immunity.
Regulation of NF-κB signaling by the A20 deubiquitinase.
Zinc-suppressed inflammatory cytokines by induction of A20-mediated inhibition of nuclear factor-κB.
아연은 세포자멸사(apoptosis) 과정에서 중요하게 대두되는 암 억제인자인 p53의 활성화에 관련되었으며, 또한 세포 단백질분해효소(protease)인 카스파제(caspase) 계열의 일련의 세포사멸 실행 효소의 활성화에도 관련되었습니다. p53은 가장 유명한 종양억제 유전자의 하나입니다. p53의 미발현이나 또는 변이형(mutant) p53의 발현은 사람의 여러 암조직에서 흔하며, 이는 항암치료와 방사선치료에 대한 암의 내성 증가와 관련되었습니다. p53에는 단백질이 DNA에 결합하는 작용에 필요한 단단히 결합된 아연원자가 들어 있다는 것이 확인되었습니다. 아연은 전립선암세포에서 세포자살작용발생(apoptogenesis)을 유도하는 것으로 밝혀졌으며, 세포자살이 유도되면서 일어나는 직접적 영향으로 카스파제 연쇄반응(caspase cascade) 활성화에 의한 미토콘드리아로부터 사이토크롬 c (cytochrome c) 방출, 그리고 최종적으로 세포자살(apoptosis)이 이루어집니다. 카스파제-6 (caspase-6)는 아연에 가장 민감한 세포자살관련 작용표적(molecular target)입니다. 카스파제-6는 프로카스파제-3이라는 효소를 분할, 활성화시키고 (자살실행효소 카스파제-3으로 전환), 또한 라민(lamin:핵 안쪽을 안정화시키는 단백질)을 절단함으로써, 핵막(nuclear membrane)의 붕괴(dissolution)에 직접적으로 관여합니다. 아연은 또한 전립선암 세포의 침윤능력을 억제하는 것으로 밝혀졌습니다.
또한 아연은 미량영양소(micronutrients),특히 철분과 구리성분의 흡수를 억제합니다. 철분은 DNA합성에 중요한 필수 세포영양소의 하나며, 모든 세포의 성장과 생존에 필요합니다. 암세포는 끊임없는 증식을 하기 위해 전형적인 건강한 세포보다 더 많은 철분이 필요하며, 종양은 철분이 풍부한 환경에서 더 잘 자랍니다. 이러한 내용은 암환자 및 암발생 위험이 높은 노년층의 치료시에 반드시 고려되어야만 합니다. 구리성분은 혈관의 증식을 촉진합니다. 철분을 배출시키는 킬레이션(chelation)이 암치료에 유용하기도 합니다. 고용량의 아연(하루 50 mg 또는 그 이상)을 몇주간 복용하면 철분과 구리의 생체이용을 저해할 수 있습니다.
다른 금속과는 달리, 아연은 고용량을 복용해도 사실상 독성이 없습니다. 아연을 세포와 조직 내로 유입시켜, 배분하고, 세포로부터 방출을 조절하는 항상성조절 기전(homeostatic mechanisms)은 매우 효과적이어서, 철분이나 구리, 수은을 비롯한 다른 금속과는 달리 과도한 아연축적과 관련된 증상으로 알려진 것은 없습니다. 다만, 장기간 고용량의 아연을 보충하면 구리성분의 흡수가 방해받게 됩니다. 그러므로, 아연의 독성효과는 실은 구리성분의 결핍에서 기인된 것입니다.
만일 세포 외부(세포외액)의 아연 농도가 아연 항상성유지 시스템(homeostatic system)의 허용능력을 초과하면 아연은 세포독성(cytotoxic)으로 작용합니다. 세포 외부(세포외액) 아연농도가 상승하면 세포 원형질막(plasma membrane)의 아연전달체계가 분해됩니다. 그 결과로 강화된 세포내 아연농도가 세포자멸사를 활성화시킵니다. 아연은 과잉도 결핍도 세포자멸사(apoptosis)를 유도합니다. 식이에서 아연섭취가 전립선내 아연수준에 영향을 미치는지 여부는 알려지지 않았습니다. 그러나 아연의 치료적 용량은 하루 50-100 mg의 원소아연(elemental zinc)입니다. 원소아연은 보충제로 판매되는 아연 시트레이트(zinc citrate) 무게의 30%이므로, 즉 50 mg의 아연 시트레이트 정제에는 단지 15 mg의 원소아연이 함유되었다는 것을 기억하시기 바랍니다. 허발짐 항암미네랄에는 100% 생체이용율(고흡수성)의 이온성 아연액(liquid ionic zinc)이 들어 있습니다. 허발짐 항암미네랄은 순수 미네랄 결정체를 완전하게 액상화 시키는 특유의 처리공정을 사용합니다. 그러므로 효과를 보기 위해서 고용량의 미네랄보충제를 복용할 필요가 없습니다. 암 예방은 생각보다 쉬울수 있지만, 암 치료는 다른 얘기입니다.
Zinc: a promising agent in dietary chemoprevention of cancer.
Crystal structure of a p53 tumor suppressor-DNA complex: understanding tumorigenic mutations.
Novel Chelators for Cancer Treatment: Where Are We Now?
Cancer cell iron metabolism and the development of potent iron chelators as anti-tumour agents.
The essential toxin: impact of zinc on human health.
Comparative absorption of zinc picolinate, zinc citrate and zinc gluconate in humans.